Resumo
ALCANCE UM MELHOR CONTROLE DA DOENÇA COM MELHORA DA FUNÇÃO RENAL E REDUÇÃO DA TOXICIDADE DE GC POR MEIO DE UM TRATAMENTO DIRECIONADO E INOVADOR PARA GPA/PAM1-4

TAVNEOS, em combinação com um regime de rituximabe ou ciclofosfamida, é indicado para o tratamento de pacientes adultos com granulomatose com poliangeíte (GPA) ou poliangeíte microscópica (PAM) nas suas formas graves e ativas.2
TAVNEOS deve ser iniciado e monitorado por profissionais de saúde com experiência no diagnóstico e tratamento de GPA ou (PAM) nas suas formas graves e ativas.2
Regime à base de TAVNEOS


atingiu remissão clínica não inferior na semana 26 e remissão clínica sustentada superior na semana 52 versus um regime à base de GC1*

resultou em um menor risco absoluto de recidiva versus um regime baseado em GC ao longo de 52 semanas1

demonstrou melhora sustentada da função renal ao longo de 1 ano versus um regime baseado em GC1

permitiu que os médicos reduzissem
o uso de GC com uma diminuição significativa da toxicidade associada ao uso de GC versus
um regime à base de GC1,5

demonstrou melhoras significativas nos domínios físicos e relacionados à saúde da QoL versus um regime baseado em GC1,6†‡

inclui TAVNEOS administrado em dose oral fixa

O TAVNEOS demonstrou um perfil de segurança aceitável1,7

O TAVNEOS é o primeiro tratamento direcionado para GPA/PAM reconhecido pela EULAR e KDIGO3,4,8,9
Referências e notas de rodapé
Notas de rodapé
*A remissão clínica no estudo ADVOCATE foi definida como BVAS igual a 0 e ausência do uso de GC nas 4 semanas anteriores.1
†Foi observada uma melhora numérica na QoL mental.6
‡Com o índice EQ-5D-5L, foram observadas melhoras numéricas na semana 26 e melhoras significativas na semana 52 (p=0,009) no regime baseado em TAVNEOS versus regime baseado em GC.6
Abreviações
VAA, vasculite associada ao ANCA; ANCA, anticorpo anticitoplasma de neutrófilos; BVAS, escala da atividade da vasculite de Birmingham; EQ-5D-5L, questionário EuroQoL de 5 dimensões e 5 níveis; EULAR, Aliança Europeia de Associações de Reumatologia; GC, glicocorticoide; GPA, granulomatose com poliangeíte; KDIGO, Kidney Disease: Improving Global Outcomes; MOA, mecanismo de ação; PAM, poliangeíte microscópica; QoL, qualidade de vida.
Referências
- Jayne D, et al. N Engl J Med 2021;384(7):599–609.
- TAVNEOS EU SmPC janeiro 2025.
- Bekker P, et al. PLoS One 2016;11(10):e0164646.
- European Medicine Agency (2021). First-in-class medicine recommended for treatment of rare blood vessel inflammation. Available at: https://www.ema.europa.eu/en/news/first-class-medicine-recommended-treatment-rare-blood-vessel-inflammation. Data de acesso: janeiro 2025.
- Stone J, et al. Semin Arthritis Rheum 2022;55:152010.
- Strand V, et al. Lancet Rheumatol 2023;5:e451–60.
- European Medicines Agency (2021). An overview of Tavneos and why it is authorised in the EU. Available at: https://www.ema.europa.eu/en/documents/overview/tavneos-epar-medicine-overview_en.pdf. Data de acesso: janeiro 2025.
- Hellmich B, et al. Ann Rheum Dis 2023;0:1–18.
- Kidney Disease: Improving Global Outcomes (KDIGO) ANCA Vasculitis Work Group. Kidney Int 2024;105(3S):S71–S116.
▼ Este produto medicinal está sujeito a monitoramento adicional. Isso permitirá a rápida identificação de novas informações de segurança. Os profissionais de saúde são solicitados a relatar quaisquer suspeitas de reações adversas.
BR-AVA-2500003 | Data de preparação: julho de 2025
Sobre a VAA
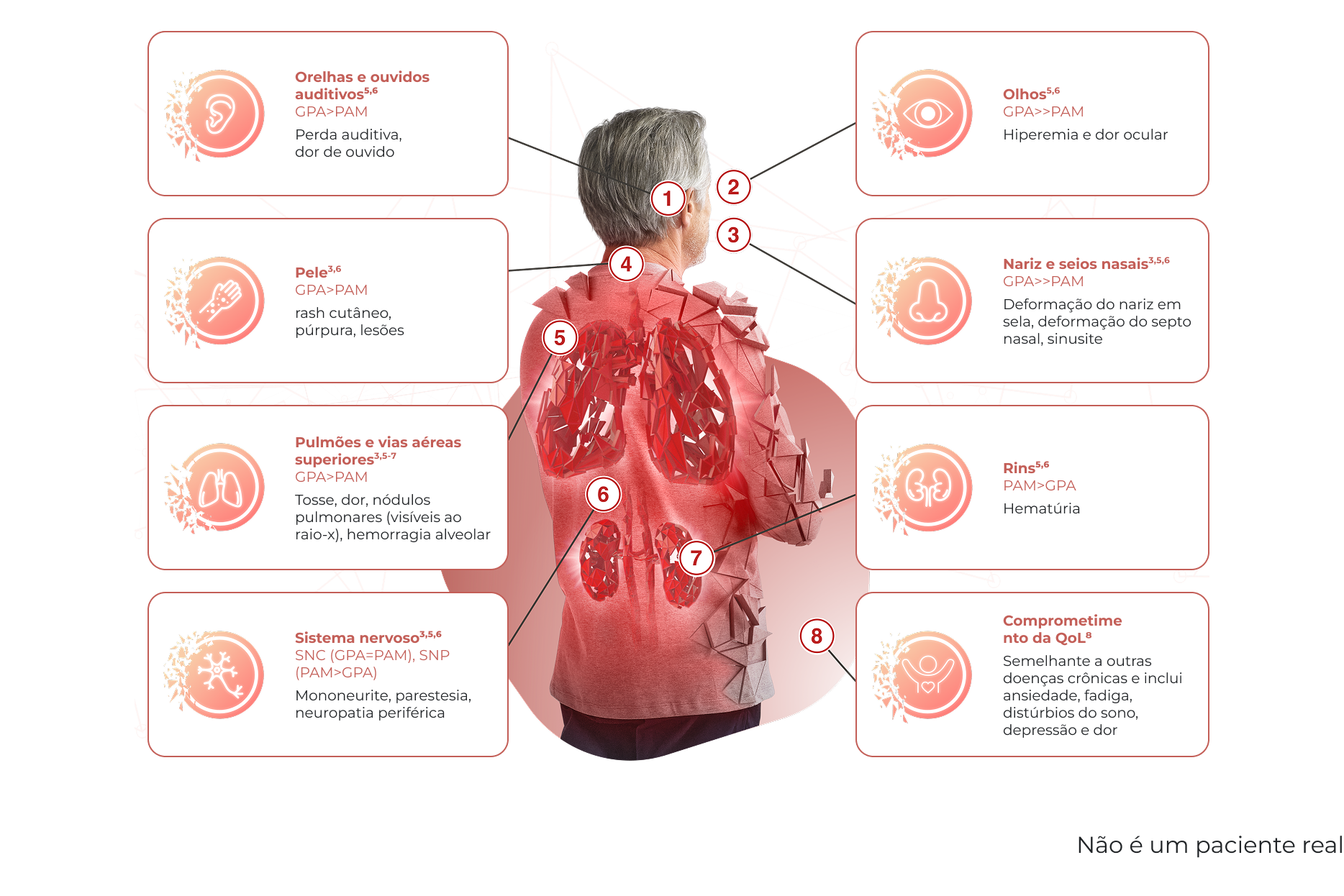
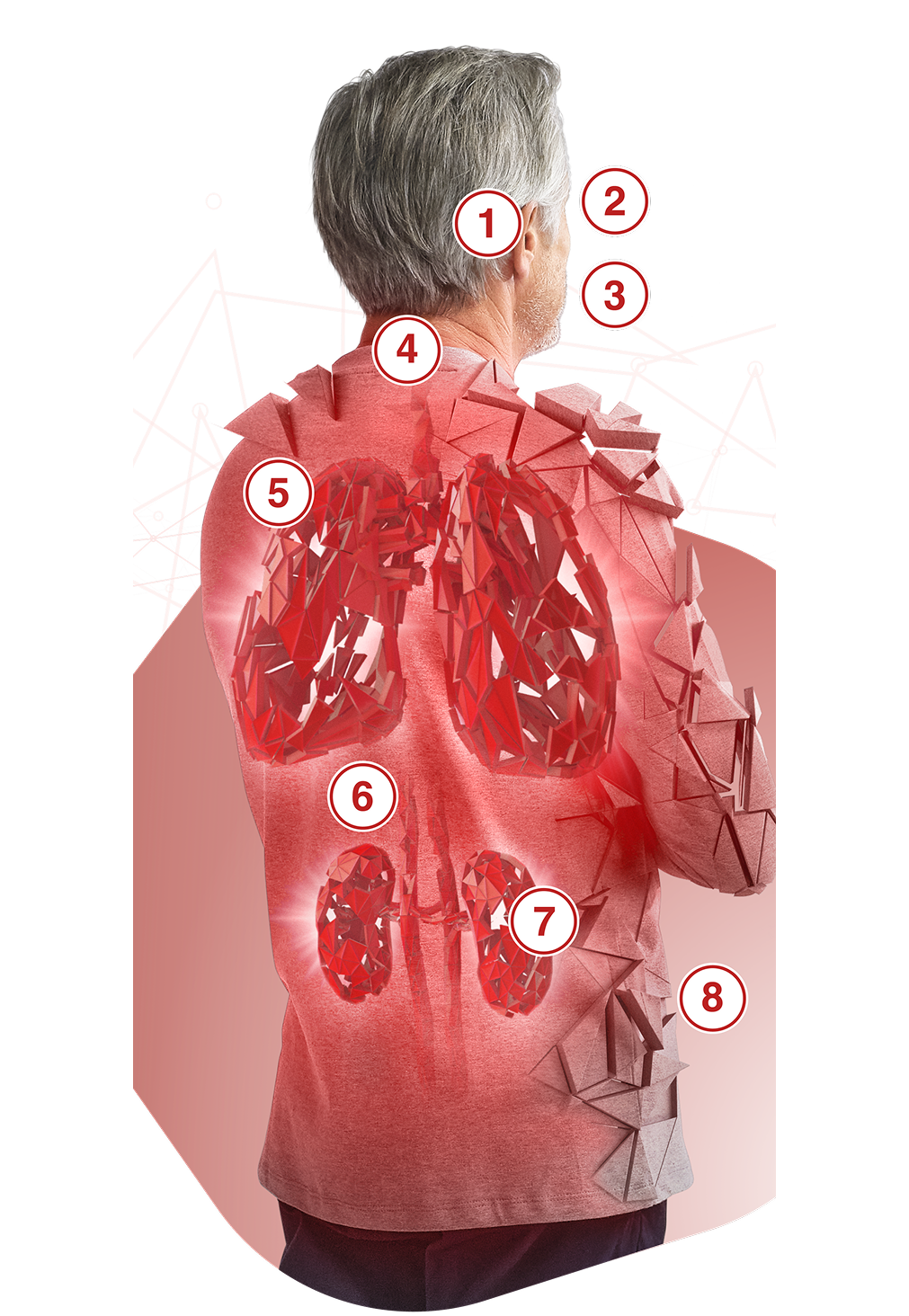
COMO SEUS PACIENTES COM VAA SE APRESENTAM?
A VAA (GPA/PAM) é uma doença grave e com recidiva que pode causar danos irreversíveis a vários órgãos2–4
É NECESSÁRIA UMA NOVA E MAIS DIRECIONADA ABORDAGEM PARA O TRATAMENTO DA VAA (GPA/PAM)9–12


A VAA (GPA/PAM) é uma doença grave e com recidiva que pode causar danos irreversíveis a vários órgãos2–4

Apesar do tratamento, muitos pacientes com VAA não alcançam ou sustentam a remissão e o risco de recidiva persiste, exacerbando ainda mais os danos nos órgãos13–15

As terapias atualmente estabelecidas para VAA (GPA/PAM) se baseiam principalmente em imunossupressores inespecíficos associados ao uso de GCs em altas doses e/ou por períodos prolongados, o que contribui para aumentar a carga da doença12,15–19

A ativação da via alternativa do complemento desempenha um papel fundamental na fisiopatologia da VAA, porém nenhuma das terapias atualmente disponíveis atualmente estabelecida aborda esta via como um fator chave da inflamação vascular10,12,20
Referências e notas de rodapé
Abreviações
VAA, vasculite associada ao ANCA; ANCA, anticorpo anticitoplasma de neutrófilos; SNC, sistema nervoso central; GC, glicocorticoide; GPA, granulomatose com poliangeíte; MOA, mecanismo de ação; PAM, poliangeíte microscópica; SNP, sistema nervoso periférico; QoL, qualidade de vida.
Referências
- TAVNEOS EU SmPC janeiro 2025.
- Wallace ZS, Miloslavsky EM. BMJ 2020;368:m421.
- Pagnoux C. Eur J Rheumatol 2016;3(3):122–33.
- Al Hussain T, et al. Adv Anat Pathol 2017;24(4):226–34.
- Hunter RW, et al. BMJ 2020;369:m1070.
- Kitching AR, et al. Nat Rev Dis Primers 2020;6(1):71.
- Quartuccio L, et al. J Autoimmun 2020;108:102397.
- Basu N, et al. Ann Rheum Dis 2014;73(1):207–11.
- Hutton HL, et al. Semin Nephrol 2017;37(5):418–35.
- Jennette JC, Nachman PH. Clin J Am Soc Nephrol 2017;12(10):1680–91.
- Bekker P, et al. PLoS One 2016;11(10):e0164646.
- Lamprecht P, et al. EMJ Rheumatol 2021;8(1):36–42.
- Stone JH, et al. N Engl J Med 2010;363(3):221–32.
- Specks U, et al. N Engl J Med 2013;369(5):417–27.
- Robson J, et al. Rheumatology (Oxford) 2015;54(3):471–81.
- Yates M, et al. Ann Rheum Dis 2016;75(9):1583–94.
- Little MA, et al. Ann Rheum Dis 2010;69(6):1036–43.
- McGregor JG, et al. Clin J Am Nephrol 2012;7(2):240–7.
- Turnbull J, Harper L. Best Pract Res Clin Rheumatol 2009;23(3):391–401.
- Liberman AC, et al. Front Endocrinol (Lausanne) 2018;9:235.
▼ Este produto medicinal está sujeito a monitoramento adicional. Isso permitirá a rápida identificação de novas informações de segurança. Os profissionais de saúde são solicitados a relatar quaisquer suspeitas de reações adversas.
BR-AVA-2500003 | Data de preparação: julho de 2025
Eficácia
ALCANCE UM MELHOR CONTROLE DA DOENÇA COM UM TRATAMENTO DIRECIONADO E INOVADOR PARA GPA/PAM1–4
Desfecho primário
MELHOR CONTROLE DA DOENÇA

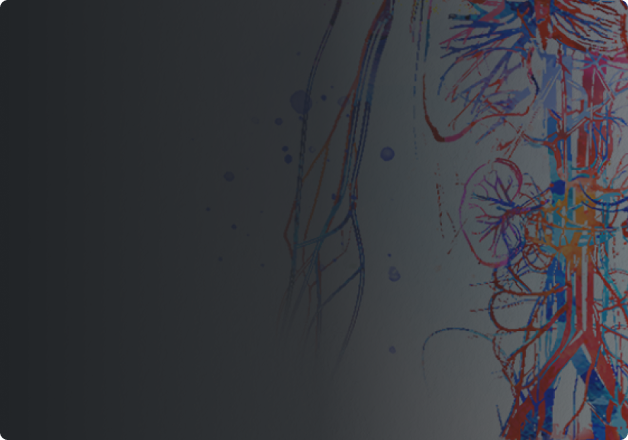
O regime baseado em TAVNEOS demonstrou não inferioridade na remissão clínica na semana 26 e superioridade na remissão clínica sustentada na semana 52 versus um regime baseado em GC2*
Na semana 26, o regime baseado em TAVNEOS demonstrou não inferioridade em atingir a remissão clínica versus o regime baseado em GC2
p<0,001 para não inferioridade
(Diferença 3,4, IC de 95%, -6,0 a 12,8)
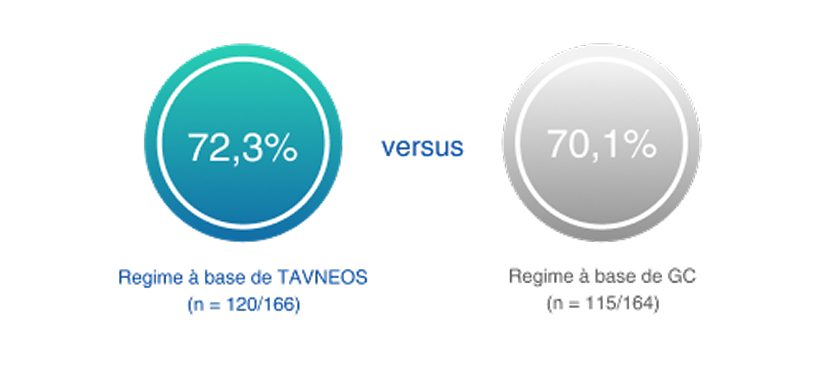
Na semana 52, o regime baseado em TAVNEOS demonstrou superioridade na remissão clínica sustentada versus um regime baseado em GC2
p=0,007 para superioridade
(Diferença 12,5, IC de 95%, 2,6 a 22,3)
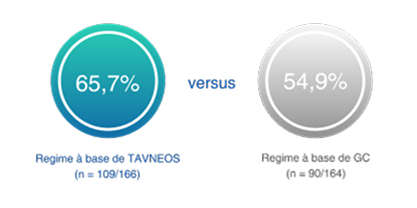

Na semana 52, o regime baseado em TAVNEOS demonstrou um número necessário para tratar (NNT) entre 8 e 10†
Desfecho secundário
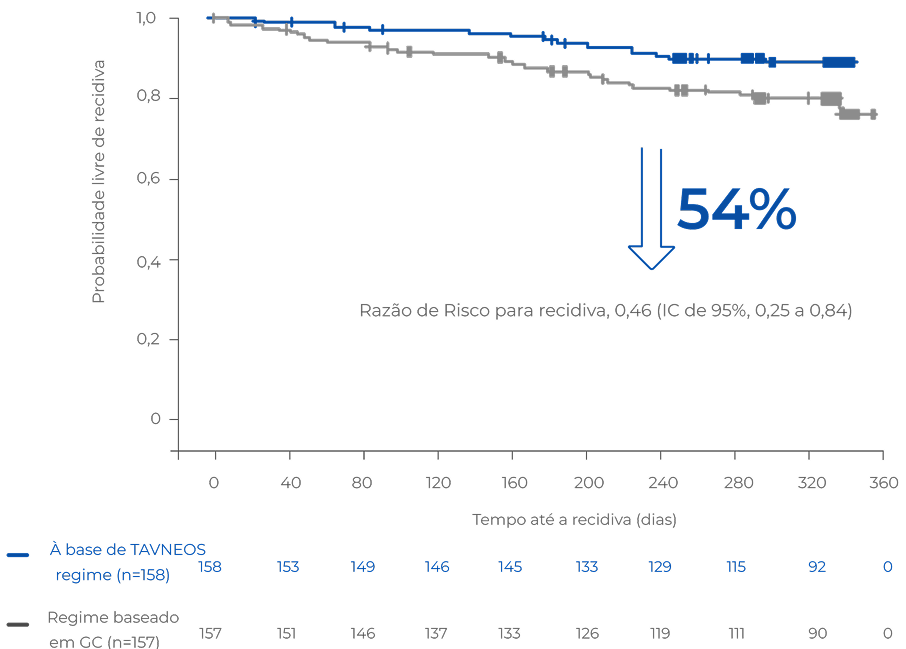
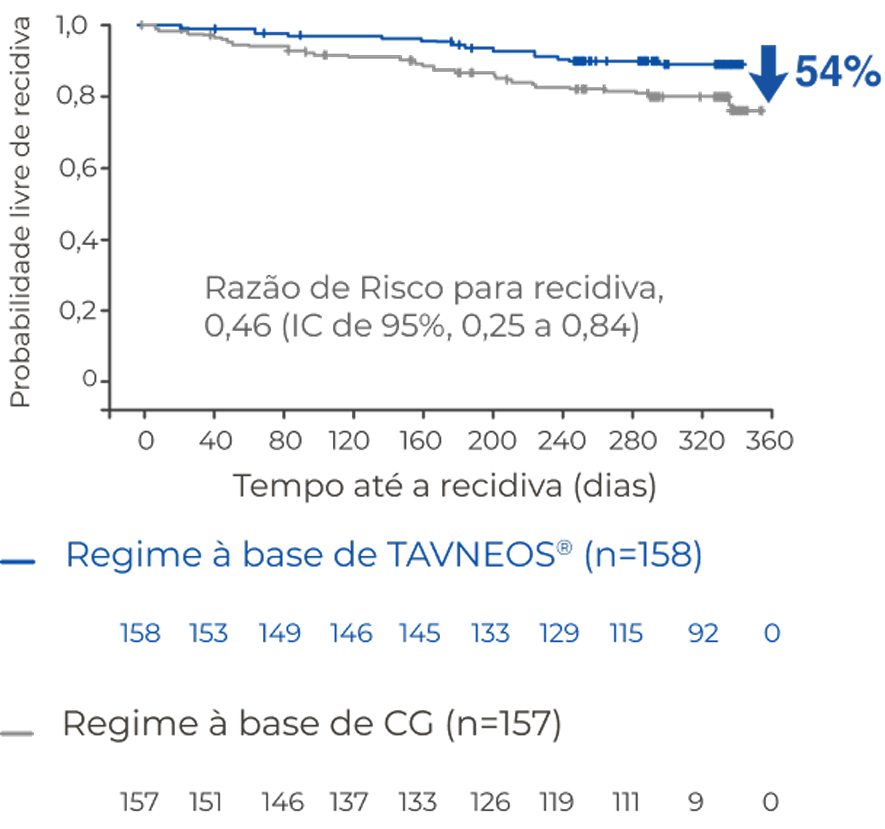
REDUÇÃO DO RISCO DE RECIDIVA

O regime baseado em TAVNEOS resultou em um menor risco absoluto de recidiva versus um regime baseado em GC ao longo de 52 semanas2
Risco absoluto de recidiva ao longo de 52 semanas de tratamento2
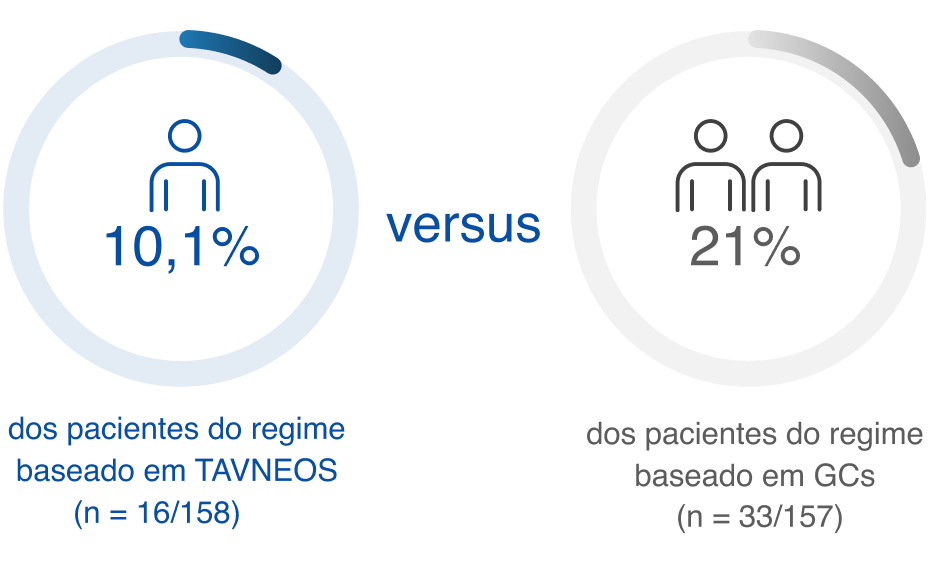

Os pacientes do grupo de GCs apresentaram duas vezes mais recidiva que o do grupo TAVNEOS2
Não houve um plano pré-especificado para ajuste dos intervalos de confiança para multiplicidade dos desfechos secundários; apenas estimativas pontuais e intervalos de confiança de 95% são apresentados, e nenhuma conclusão definitiva pode ser tirada a partir desses dados2
DESENHO DO ESTUDO ADVOCATE

Estudo pivotal fase 3, multicêntrico, internacional, comparador ativo, randomizado, duplo-cego, duplo-pareado, controlado, de 52 semanas, com pacientes randomizados para receber TAVNEOS 30 mg duas vezes ao dia (N=166) ou esquema de redução gradual de prednisona por 20 semanas (60 mg por dia reduzidos até a descontinuação na semana 21) (N=164) em adição à ciclofosfamida (seguido de azatioprina) ou ao rituximabe.2
Pacientes randomizados para o grupo TAVNEOS NÃO receberam GCs fornecidos pelo estudo. Os pacientes em ambos os regimes poderiam usar GCs não fornecidos pelo estudo durante todo o estudo de 52 semanas, a critério médico, por agravamento da VAA ou por outras razões clínicas. GCs fornecidos fora do estudo durante a triagem tiveram que ser reduzidos gradualmente para ≤20 mg por dia antes da entrada no estudo e posteriormente para 0 mg até o final da semana 4 do estudo.5
Principais critérios de inclusão e exclusão5
Critérios de inclusão
- ≥12 anos de idade*
- GPA ou PAM recém-diagnosticado ou em recidiva de acordo com as definições da Conferência de Consenso de Chapel Hill
- Indicado para tratamento com RTX ou CYC
- MPO+ ou PR3+
- TFGe estimada de ≥15 ml/min/1,73 m2
- Presença de pelo menos um item grave ou três não graves, ou pelo menos dois critérios renais de hematúria e proteinúria conforme a BVAS
Critérios de exclusão
- Hemorragia alveolar exigindo ventilação pulmonar invasiva com duração prevista para além da triagem
- Qualquer outra doença autoimune multissistêmica
- Coagulopatia ou distúrbio hemorrágico
- Exigiu diálise ou plasmaférese nas 12 semanas anteriores à triagem
- Transplante renal
- Ter recebido CYC em até 12 semanas antes da triagem, RTX em até 12 meses antes da triagem (ou até 6 meses caso haja reconstituição das células B, com contagem de CD19 >0,01x109/l), dose cumulativa de GCs IV >3 g em até 4 semanas ou GCs orais de >10 mg por dia de prednisona (ou equivalente) por >6 semanas continuamente antes da triagem
*Pacientes adultos e adolescentes com GPA/PAM participaram deste estudo. Para obter detalhes adicionais, acesse clinicaltrials.gov, código do estudo: NCT02994927
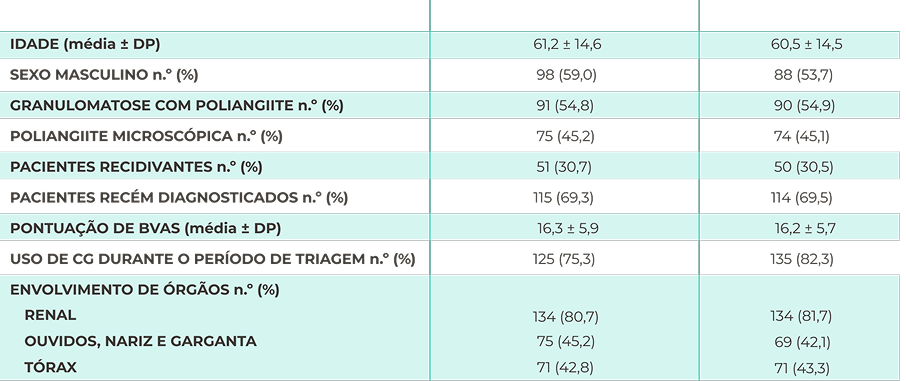
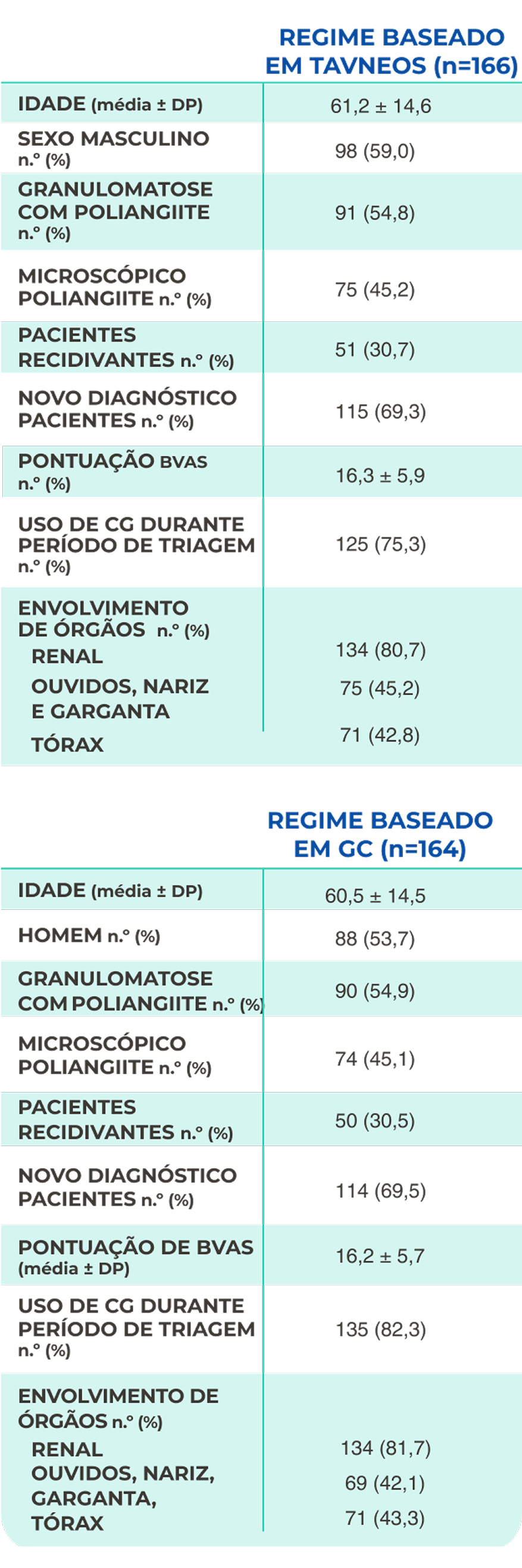
Características da avaliação inicial22
Desfechos primários2
Desfechos secundários2,5,6
Não houve um plano pré-especificado para ajuste dos intervalos de confiança em razão da multiplicidade dos desfechos secundários; apenas estimativas pontuais e intervalos de confiança de 95% são apresentados, e nenhuma conclusão definitiva pode ser tirada a partir desses dados2
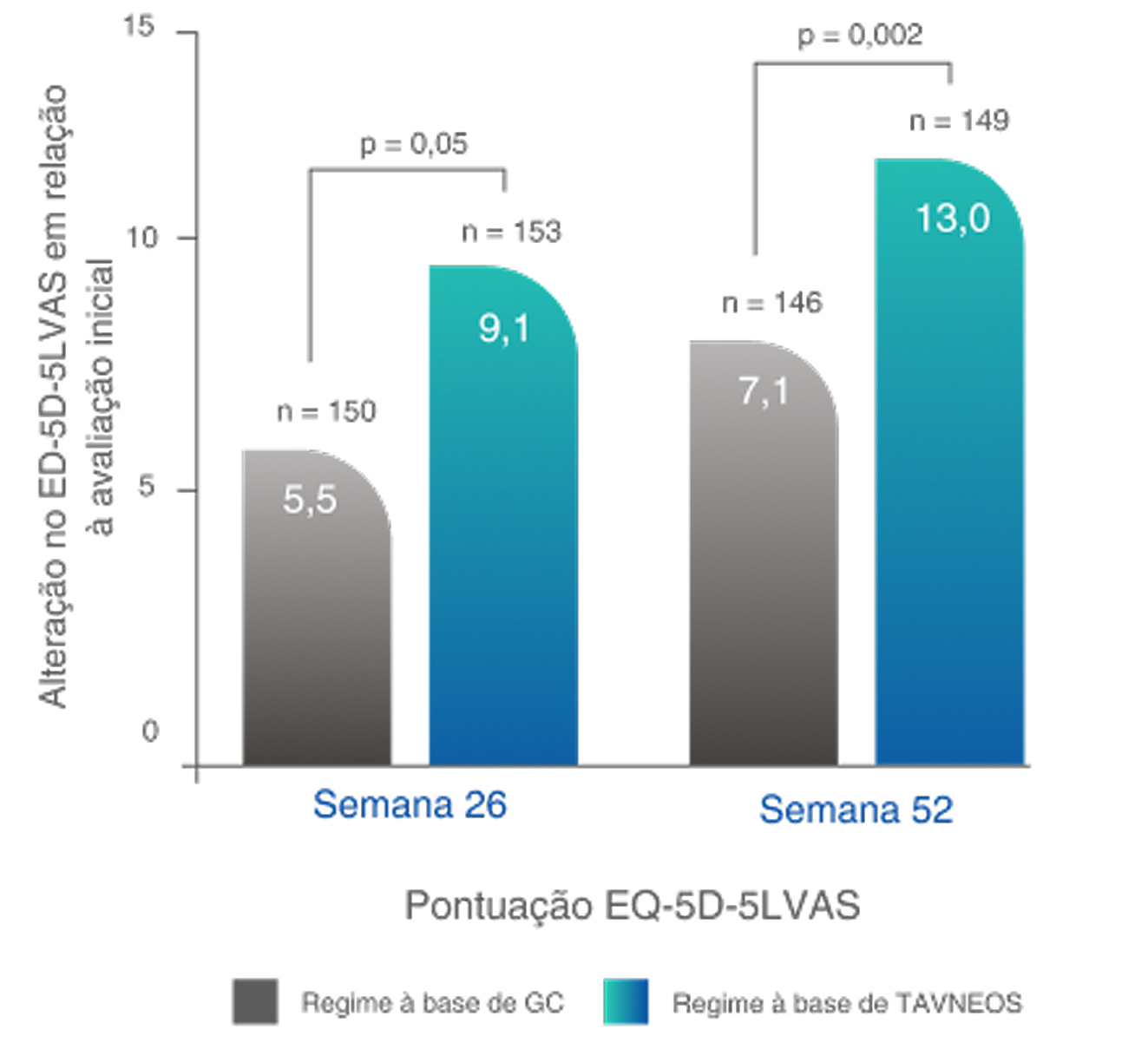
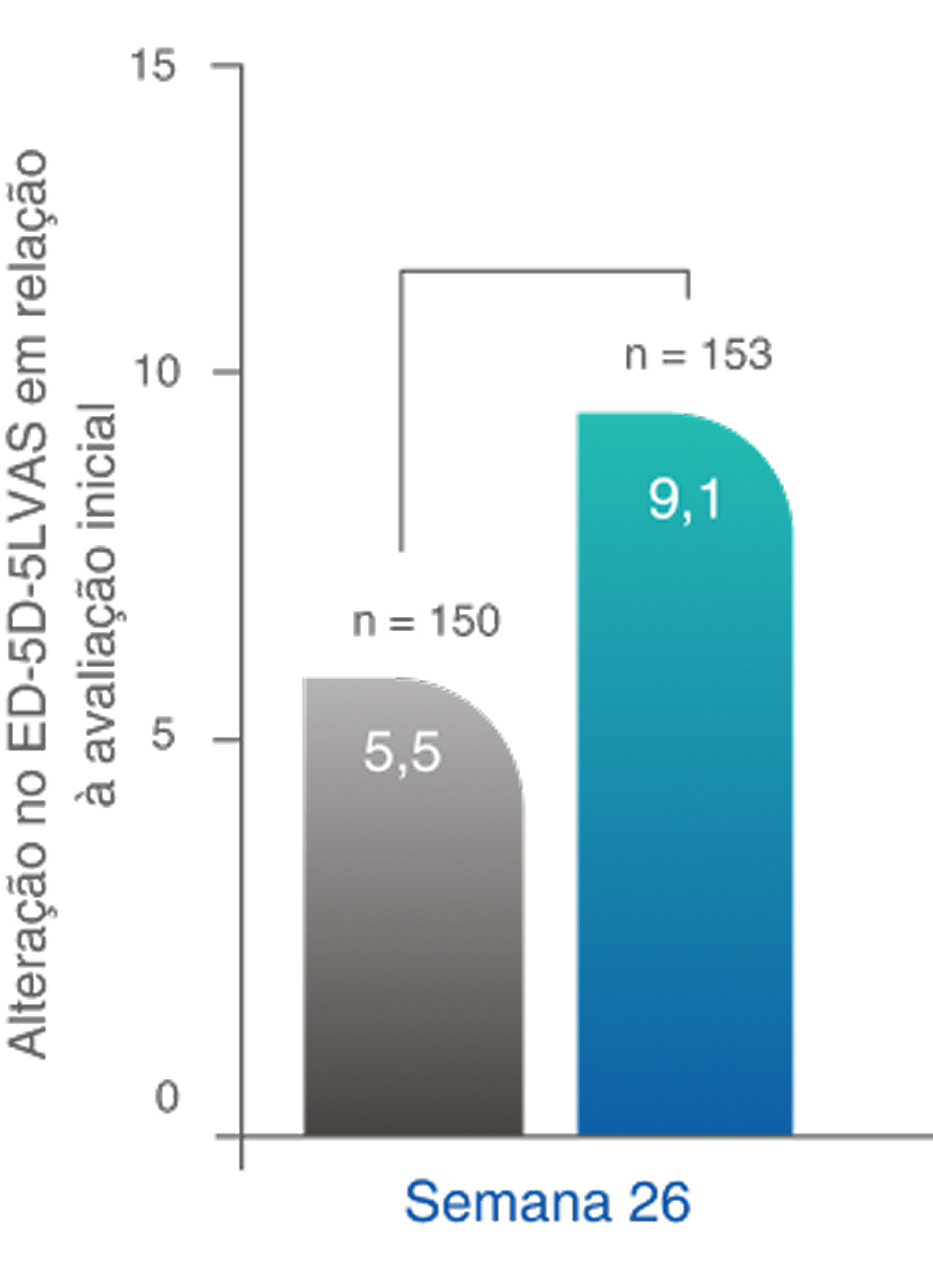
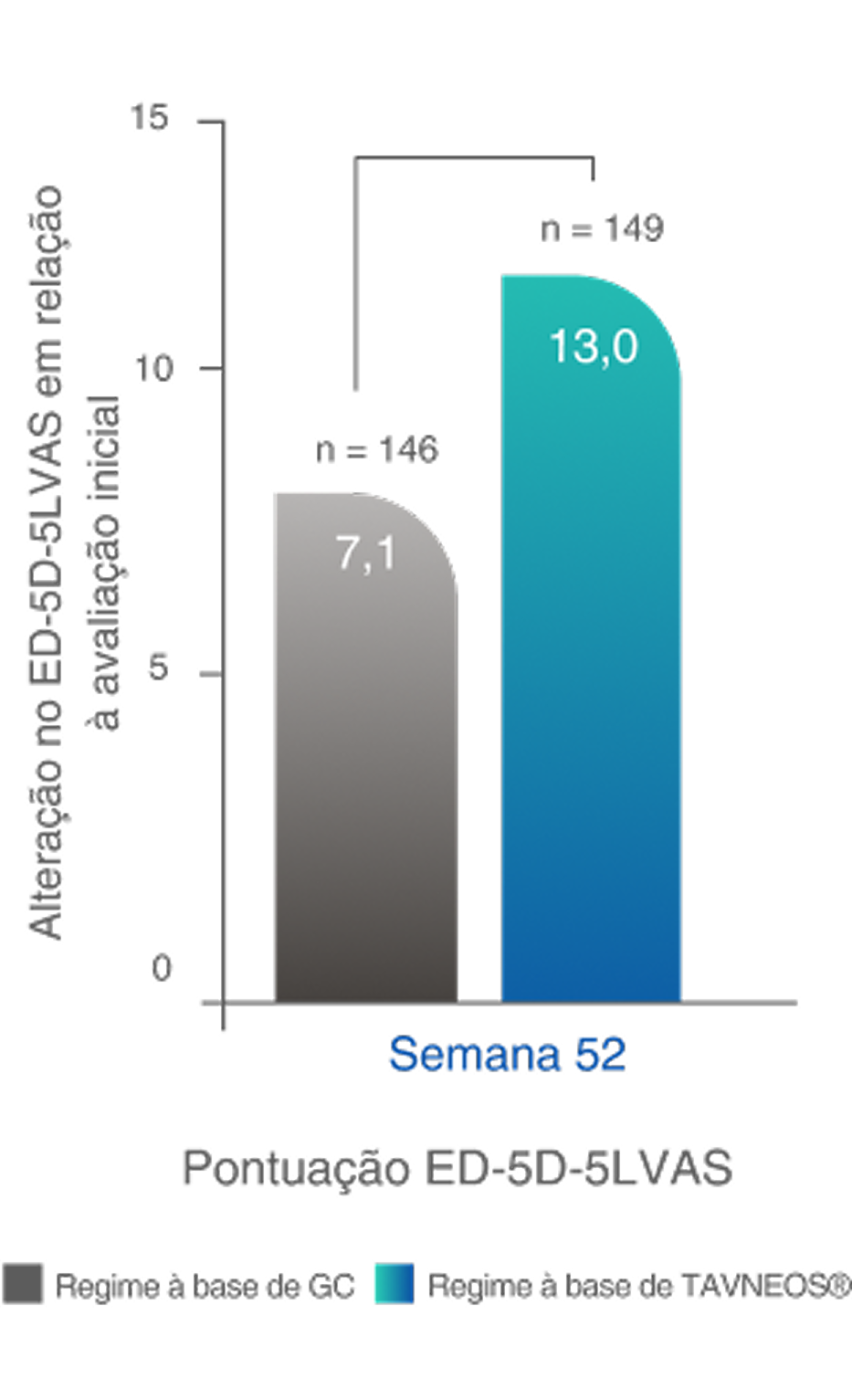
*A QoL relacionada à saúde foi medida usando duas pontuações: pontuação da EVA do EQ-5D-5L e índice do EQ-5D-5L. Foram observadas melhoras significativas na pontuação da EVA do EQ-5D-5L no regime baseado em TAVNEOS na semana 26 (p=0,05) e na semana 52 (p=0,002) comparado ao regime baseado em GC. Com o índice EQ-5D-5L, melhoras numéricas foram observadas na semana 26 e melhoras significativas foram observadas na semana 52 (p=0,009) no grupo TAVNEOS versus grupo de GC5,6
Desfecho secundário
MELHORA SUSTENTADA NA FUNÇÃO RENAL AO LONGO DE 52 SEMANAS

O grupo que recebeu TAVNEOS demonstrou melhoras significativas na TFGe2
Melhoras na TFGe em 26 e 52 semanas (desfecho secundário)2,7
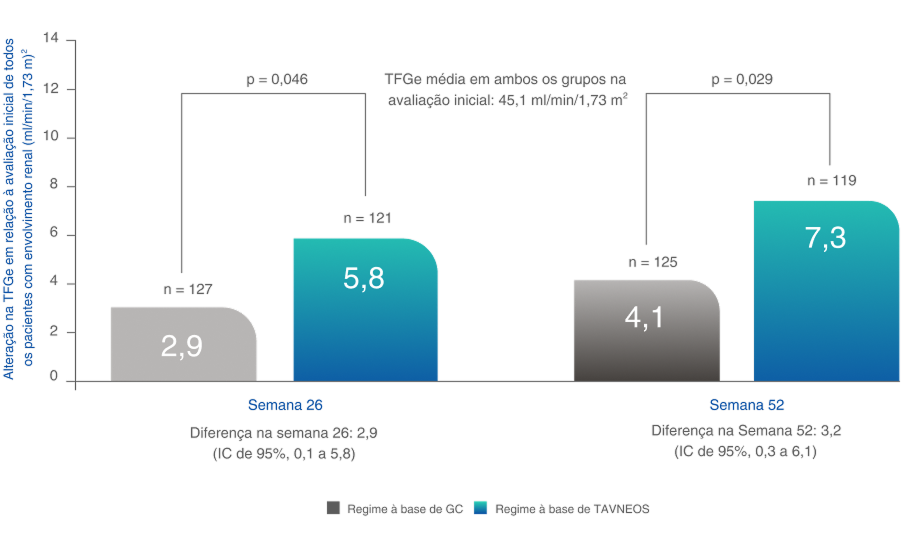
Análise post-hoc
Beneficios significativos especialmente em pacientes com a menor função renal na avaliação inicial2,7-9
Em pacientes com DRC em estágio 4 (TFGe <30 ml/min/1,73 m2):2,7-9

ml/min/1,73 m2 de aumento da TFGe no grupo TAVNEOS (n=52) versus +8,2 ml/min/1,73 m2 no grupo GC (n=48) na semana 52 (p=0,005) (diferença 5,6, IC de 95%, 1,7 a 9,5)
Em pacientes com DRC em estágio 4 (TFGe ≤ 20 ml/min/1,73 m2):7

mL/min/1,73 m2 de aumento da TFGe grupo TAVNEOS (n=27) versus +7,7 mL/min/1,73 m2 no regime baseado em GC (n=23) na Semana 52 (p=0,003) (diferença 8,4, IC de 95%, 2,9 a 13,8)
Não houve um plano pré-especificado para ajuste dos intervalos de confiança em razão da multiplicidade dos desfechos secundários; apenas estimativas pontuais e intervalos de confiança de 95% são apresentados, e nenhuma conclusão definitiva pode ser tirada a partir desses dados2
Desfecho secundário
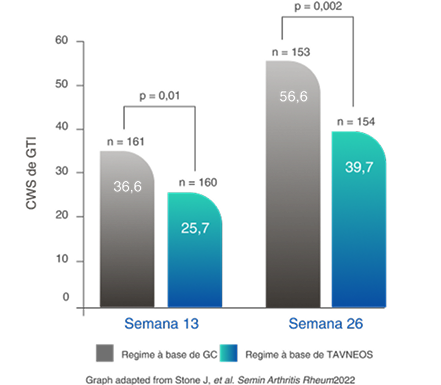
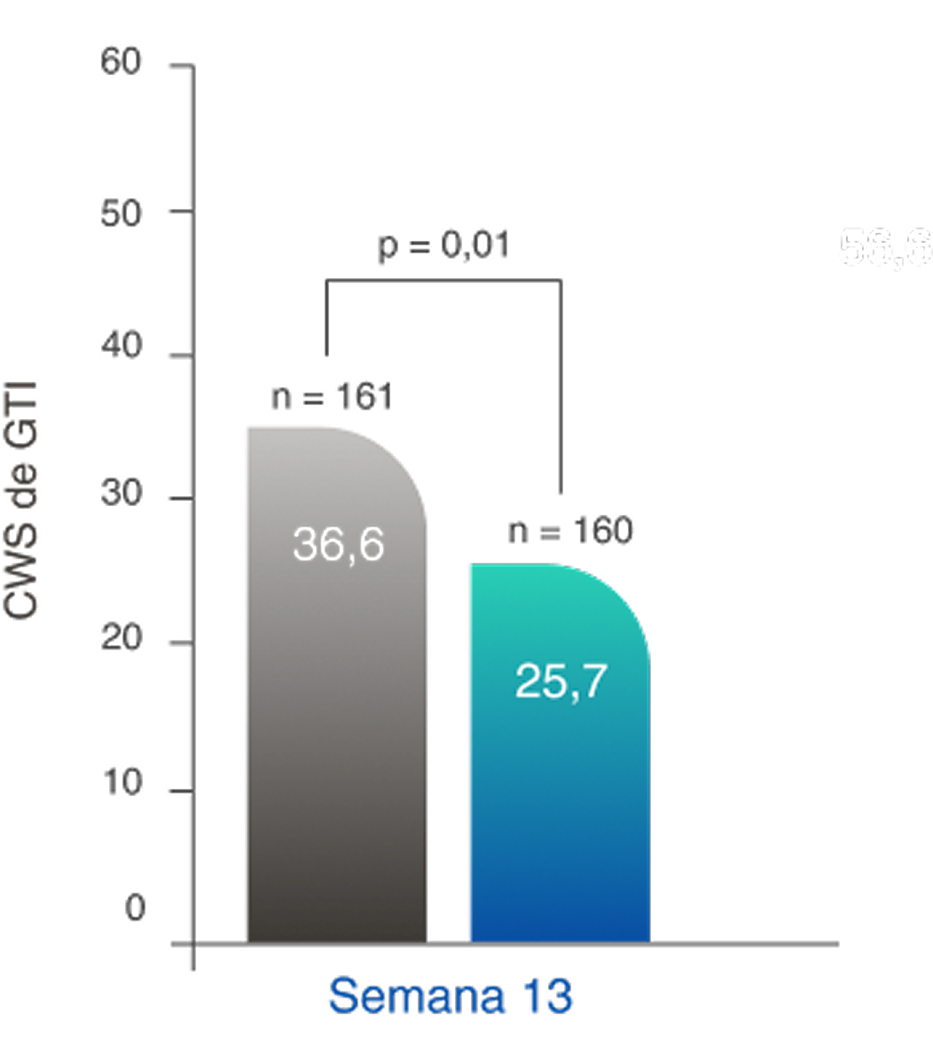
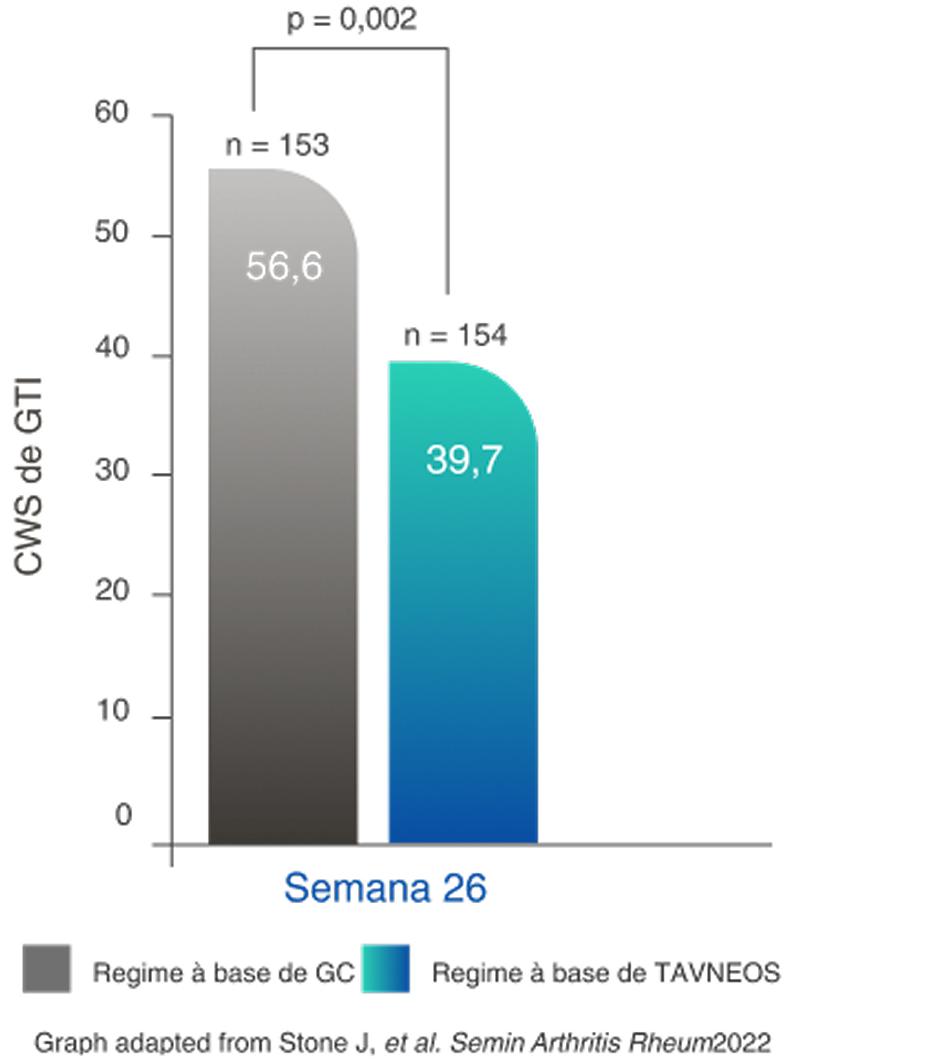
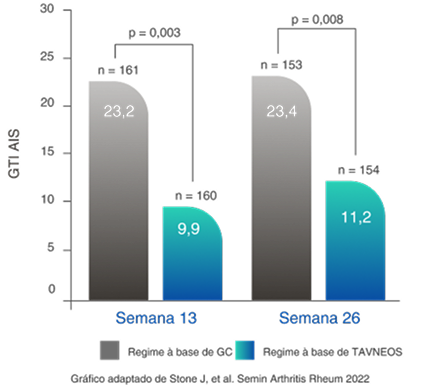
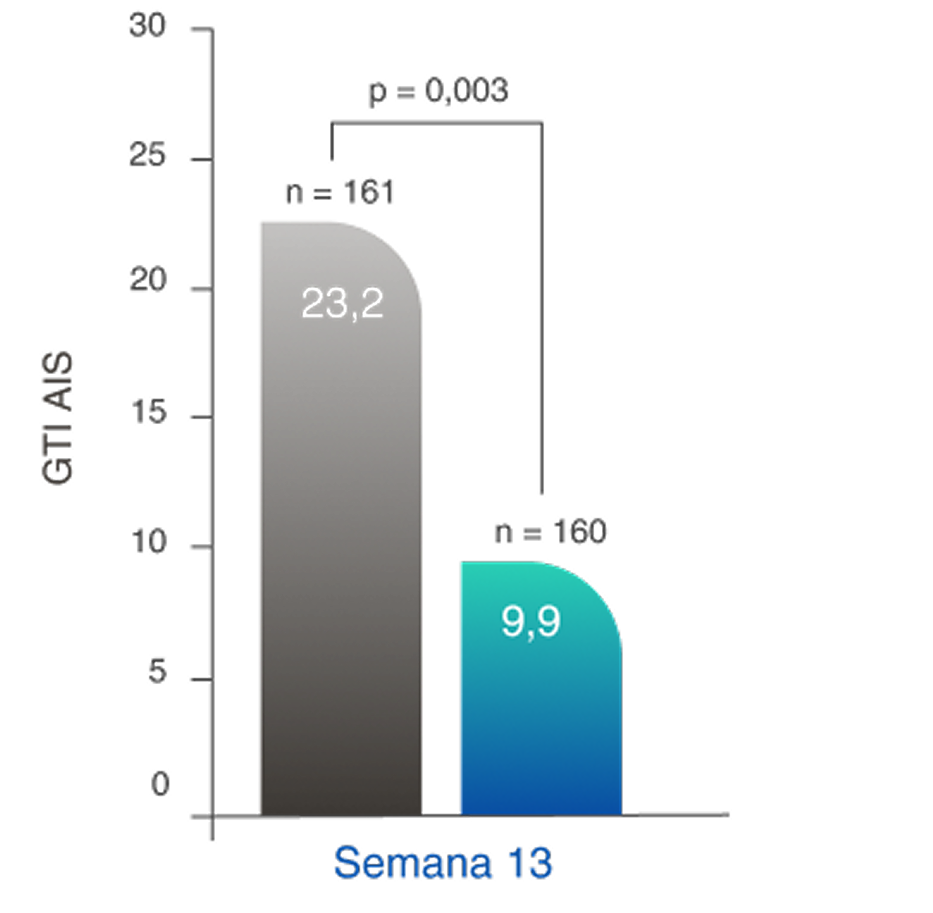
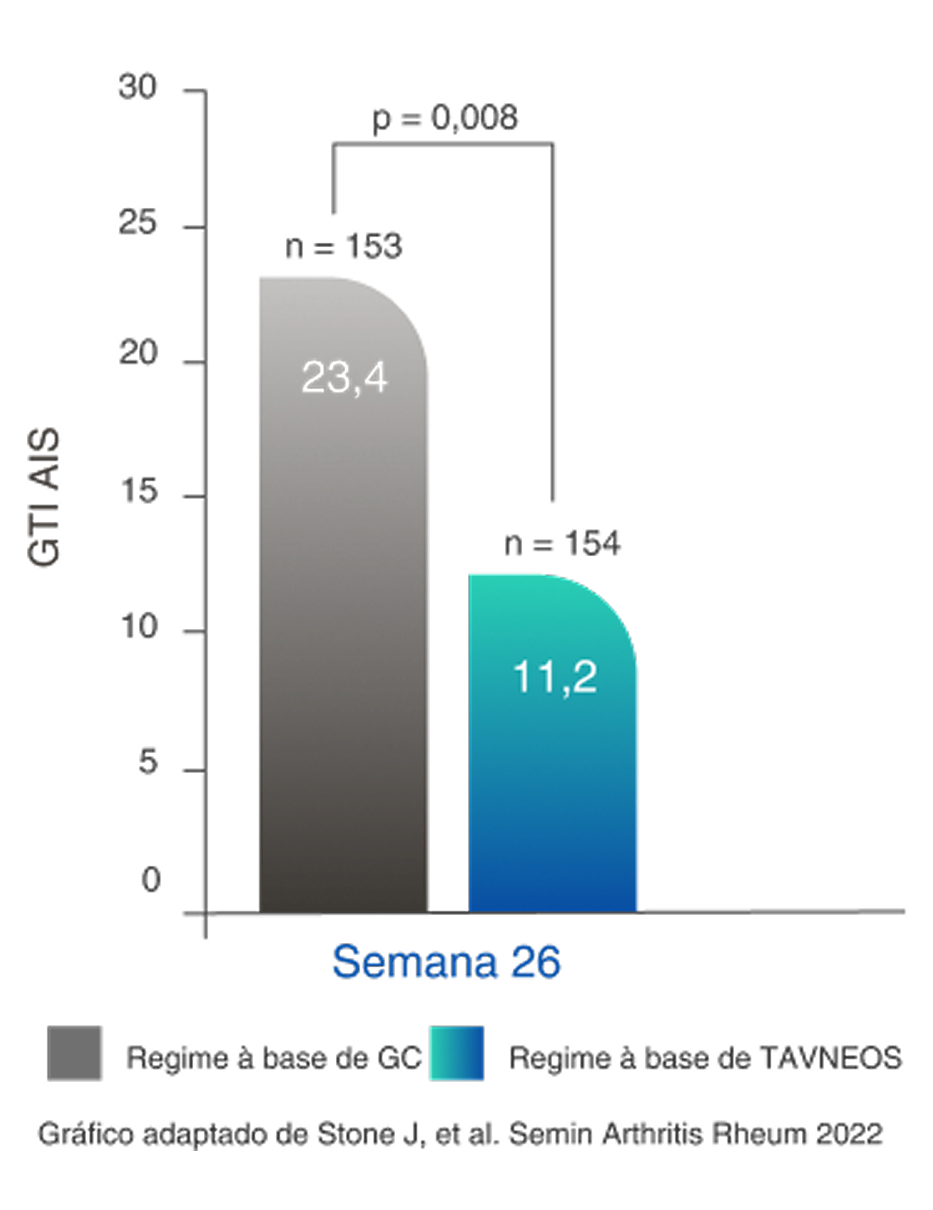
TOXICIDADE DE GLICOCORTICOIDE REDUZIDA

Regime baseado em TAVNEOS demonstrou uma redução significativa na toxicidade de GC2,11

Redução na pontuação de agravamento cumulativa de GTI (PAC) no regime baseado em TAVNEOS versus regime baseado em GC na semana 262,11
Diferença na semana 13: -11,0 (IC de 95%, -19,7 a -2,2)
Diferença na semana 26: -16,8 (IC de 95%, -25,6 a -8,0)
Aumento da PAC da GTI conforme novas toxicidades são relatadas (p. ex., agravamento da hipertensão, infecção), mas não diminuem quando ocorrem melhoras12

Redução na pontuação de melhora agregada de GTI (PMA) no regime baseado em TAVNEOS versus regime baseado em GC na semana 262,11
Diferença na semana 13: -13,3 (IC de 95%, -22,2 a -4,4)
Diferença na semana 26: -12,1 (IC de 95%, -21,1 a -3,2)
Aumento da PMA do GTI quando toxicidades são relatadas e diminuição quando ocorre melhora12
Não houve um plano pré-especificado para ajuste dos intervalos de confiança para multiplicidade dos desfechos secundários; apenas estimativas de pontos e intervalos de confiança de 95% são apresentados, e nenhuma conclusão definitiva pode ser tirada a partir desses dados2
Desfecho secundário
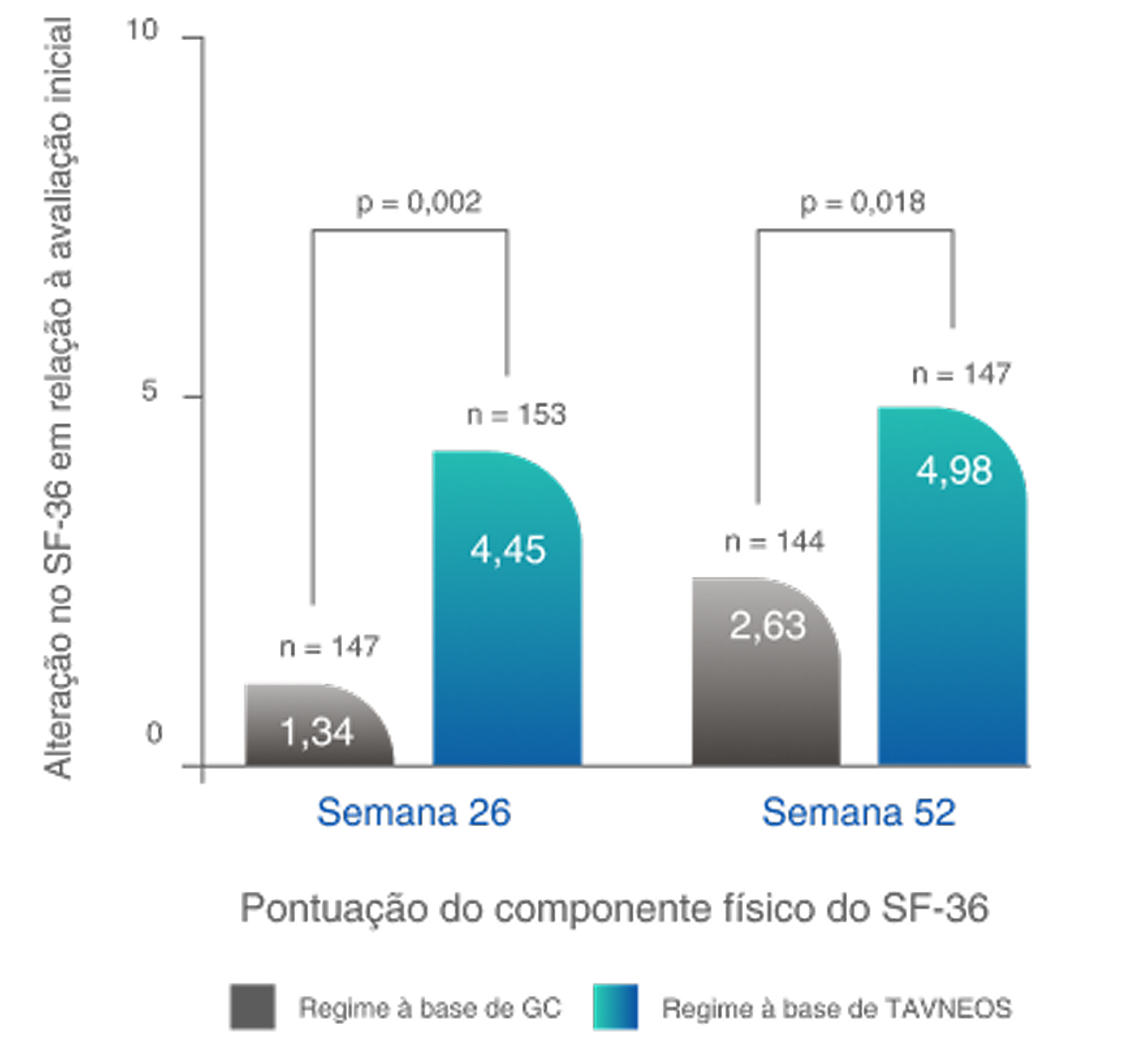
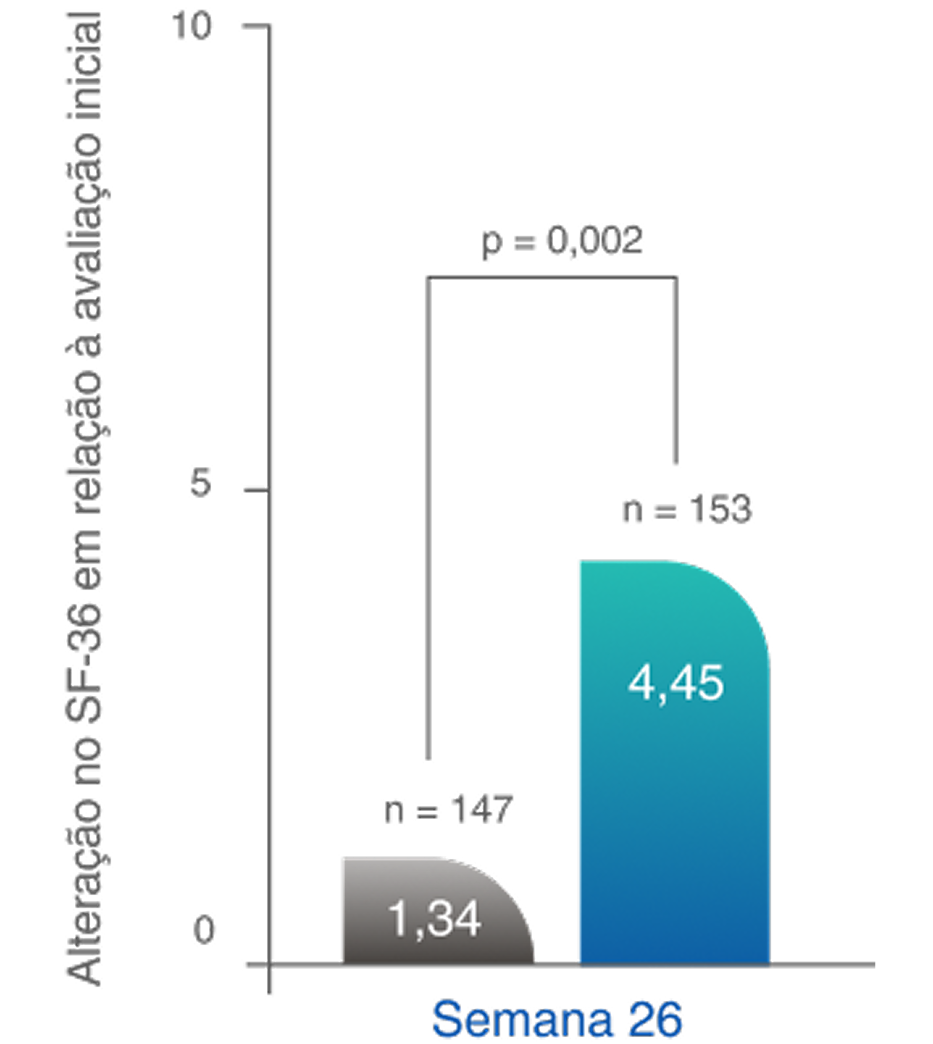
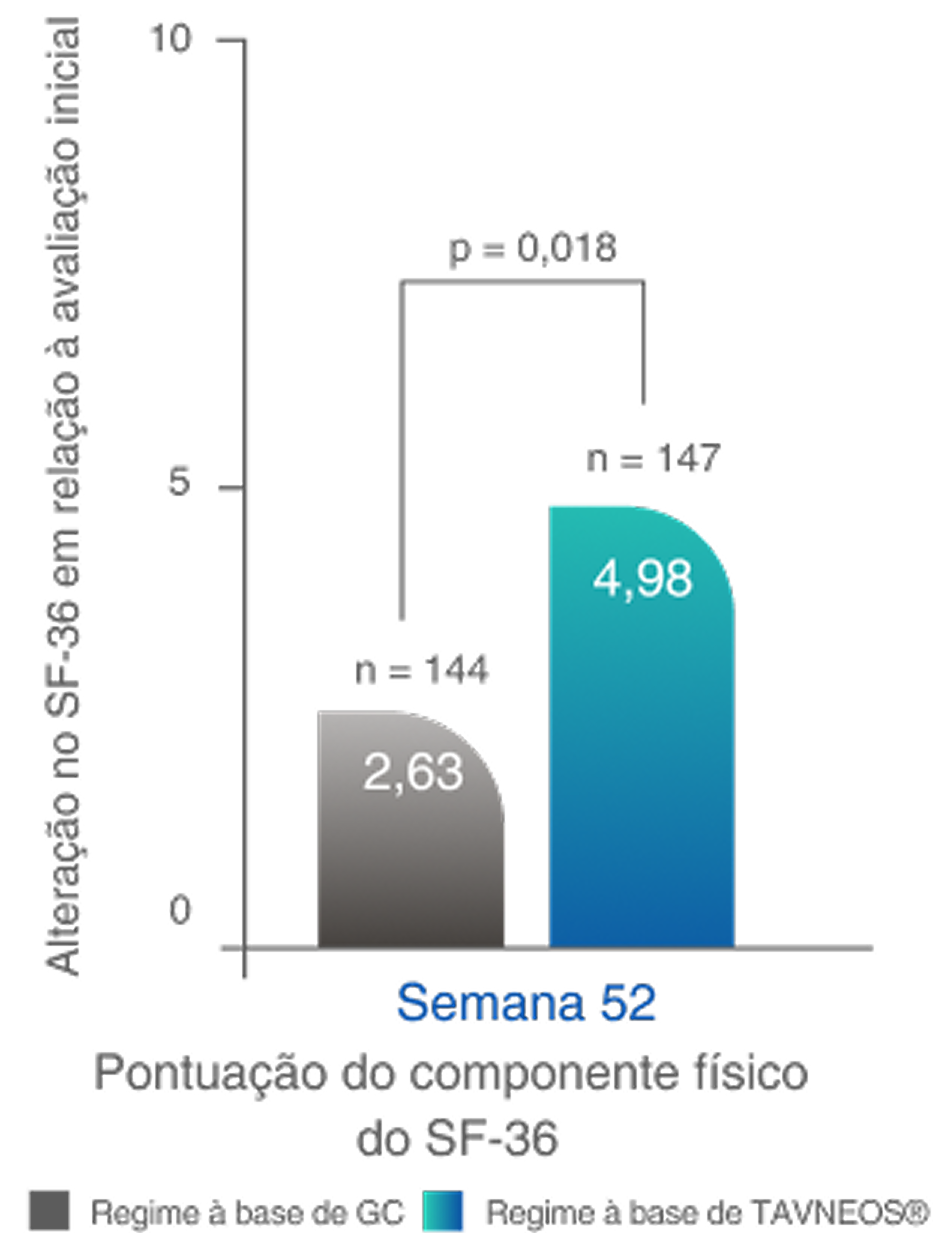
MELHOR QUALIDADE DE VIDA

O regime baseado em TAVNEOS demonstrou melhoras significativas nos domínios físicos e relacionados à saúde da QoL2,10
Melhoras significativas na QoL física na Semana 522,10‡
Diferença na semana 26: 3,10 (IC de 95%, 1,17 a 5,03)
Diferença na Semana 52: 2,35 (IC de 95%, 0,40 a 4,31)
Melhoras significativas na QoL relacionada à saúde na semana 521,10§
Diferença na semana 26: 3,6 (IC de 95%, -0,1 a 7,2)
Diferença na Semana 52: 5,9 (IC de 95%, 2,3 a 9,6)

ADVOCATE é o primeiro estudo a mostrar uma diferença significativa na QoL entre os grupos de tratamento2,5,13–15
Não houve um plano pré-especificado para ajuste dos intervalos de confiança para multiplicidade dos desfechos secundários; apenas estimativas de pontos e intervalos de confiança de 95% são apresentados, e nenhuma conclusão definitiva pode ser tirada a partir desses dados2
Referências e notas de rodapé
Notas de rodapé
*A remissão clínica no estudo ADVOCATE foi definida como BVAS 0 e nenhum uso de GC nas 4 semanas anteriores.2
†O NNT foi calculado usando https://www.statology.org/confidence-interval-difference-in-proportions-calculator/ para determinar os intervalos de confiança para a diferença bruta em proporções. Na semana 52, as taxas de resposta foram de 65,7% no grupo TAVNEOS e 54,9% no grupo de GC. Isso resultou em um resultado bruto de NNT = 1/(0,657-0,549) = 9,26, arredondado para 10 pacientes. Usando o modelo ajustado e a diferença comum estimada, o NNT = 1/0,125 = 8. Concluindo, o NNT fica entre 8 e 10 pacientes na semana 52.2
‡Foi observada uma melhora numérica na QoL mental.10
§Com o índice EQ-5D-5L, foram observadas melhoras numéricas na Semana 26 e melhoras significativas na Semana 52 (p=0,009) no grupo TAVNEOS versus regime baseado em GC.10
Abreviações
Abreviações
VAA, Vasculite associada ao ANCA; PMA, Pontuação de melhora agregada; ANCA, anticorpo anti-citoplasma de neutrófilos; PAVB, Pontuação da atividade da vasculite de Birmingham; CD19, grupo de diferenciação 19; IC, intervalo de confiança; DRC, doença renal crônica; PAC, Pontuação de agravamento cumulativa; CYC, ciclofosfamida; TFGe, taxa de filtração glomerular estimada; EQ-5D-5L, EuroQol 5 dimensões 5 níveis; GC, glicocorticoide; GPA, granulomatose com poliangeíte; GTI, Índice de toxicidade de glicocorticoides; IV, intravenoso; MCP-1, proteína quimiotática de monócitos-1; MOA, mecanismo de ação; PAM, poliangeíte microscópica; MPO, mieloperoxidase; NNT, número-necessário-para-tratar; PR-3 proteinase-3; QoL, qualidade de vida; RTX rituximabe; DP, desvio padrão; SF-36, Pesquisa de Saúde de Formulário Curto de 36 Itens ; UACR, razão albumina:creatinina urinária; EVA, escala visual analógica.
Referências
- TAVNEOS EU SmPC janeiro de 2025.
- Jayne D, et al. N Eng J Med 2021; 384(7): 599–609.
- Bekker P, et al. PLoS One 2016;11(10):e0164646.
- European Medicine Agency (2021). First-in-class medicine recommended for treatment of rare blood vessel inflammation. Available at: https://www.ema.europa.eu/en/news/first-class-medicine-recommended-treatment-rare-blood-vessel-inflammation. Date accessed: January 2025.
- Jayne D, et al. N Engl J Med 2021;384(7):599–609. [Supp Appendix].
- TAVNEOS EPAR. Available at: https://www.ema.europa.eu/en/documents/assessment-report/tavneos-epar-public-assessment-report_en.pdf. Data de acesso: janeiro de 2025.
- Cortazar F, et al. Kidney Int Rep 2023;8(4):860–70.
- Jayne D, et al. J Am Soc Nephrol 2021:32.
- NHS (2019). Chronic Kidney Disease. Available at: https://www.nhs.uk/conditions/kidney-disease/diagnosis/. Date accessed: January 2025.
- Strand V, et al. Lancet Rheumatol 2023;5:e451–60.
- Stone J, et al. Semin Arthritis Rheum 2022;55:152010.
- McDowell P, et al. J Allergy Clin Immunol Pract 2021;9(1):365–72.
- Stone JH, et al. N Engl J Med 2010;363(3):221–32.
- Walsh M, et al. N Engl J Med 2020;382(7):622–31.
- Charles P, et al. Ann Intern Med 2020;173(3):179–87.
▼ Este produto medicinal está sujeito a monitoramento adicional. Isso permitirá a rápida identificação de novas informações de segurança. Os profissionais de saúde são solicitados a relatar quaisquer suspeitas de reações adversas.
BR-AVA-2500003 | Data de preparação: julho de 2025
Segurança e dosagem
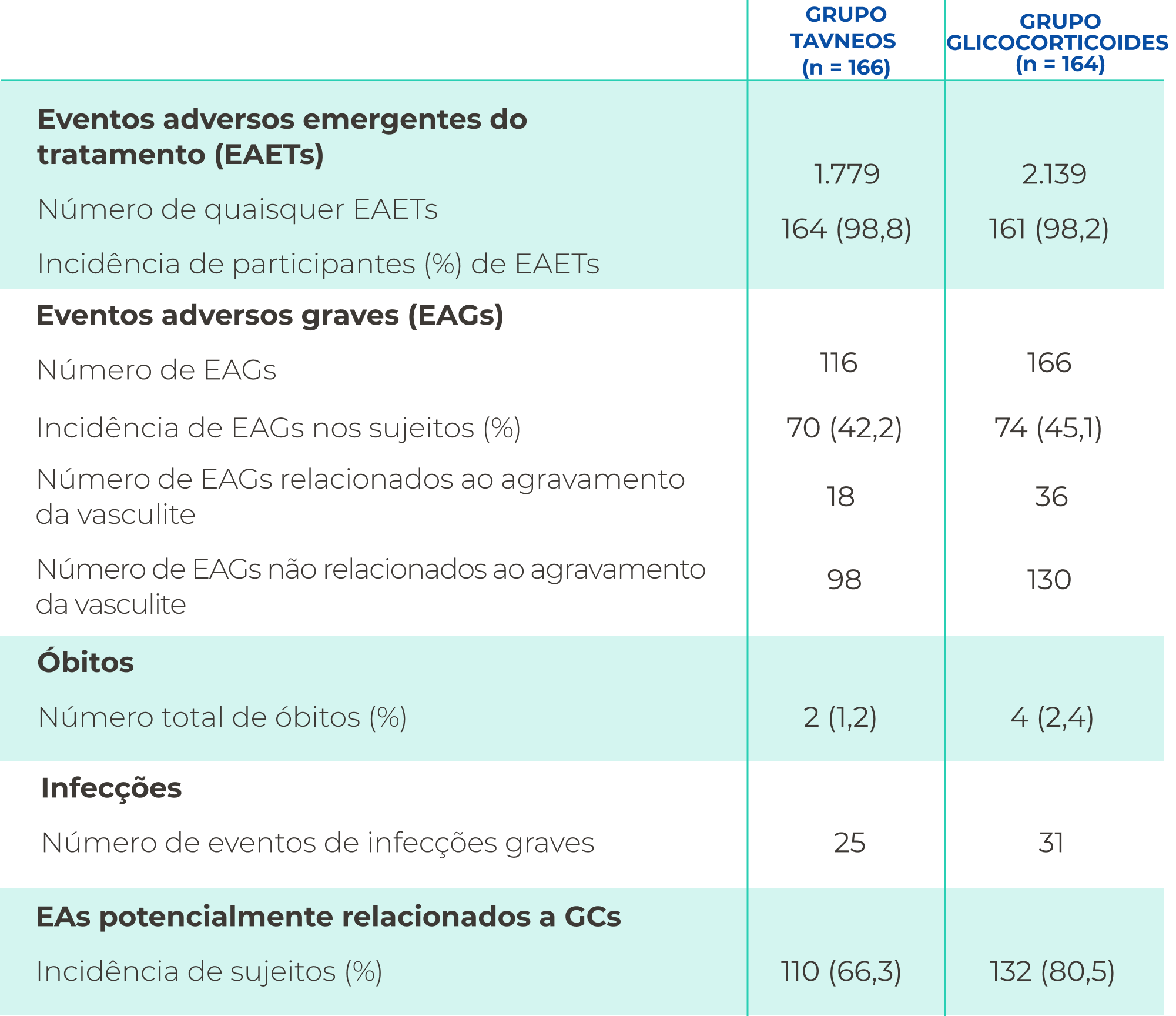
PERFIL DE SEGURANÇA
O TAVNEOS demonstrou um perfil de segurança aceitável2,3
As reações adversas mais comuns observadas em um estudo pivotal, fase 3 em pacientes tratados com TAVNEOS foram:

Náusea
23.5%

Cefaléia
20.5%

Diminuição na contagem de leucócitos
18.7%

Nasofaringite
15.1%

Diarreia
15.1%

Vômito
15.1%

Infecção do
trato respiratório superiortract infection
14.5%

As reações adversas graves mais comuns são alterações da função hepática (5,4%) e pneumonia (4,8%)1
No pós-comercialização: foram relatados (frequencia desconhecida) lesão hepática induzida por medicamento e síndrome do desaparecimento dos ductos biliares

TAVNEOS é um substrato da CYP3A4, mas interações clinicamente relevantes são improváveis quando o TAVNEOS é coadministrado com indutores ou inibidores dessa enzima1
RESULTADOS DE SEGURANÇA COMPARÁVEIS

A incidencia de EAGs observada foi numericamente semelhante nos regimes à base de TAVNEOS e de GCs2

Na análise de segurança agregada, a primeira taxa de incidência de EA em pacientes, taxa de EA, taxa de EAGs, taxa de evento de infecção e taxa de redução de contagem de leucócitos foram estatisticamente menores no grupo TAVNEOS em comparação ao grupo que recebeu GCs GC4
DOSE FIXA VIA ORAL E MONITORAMENTO

TAVNEOS é tomado em dose oral fixa, com o monitoramento necessário1
TAVNEOS deve ser administrado da seguinte forma:1

30 mg TAVNEOS

duas vezes ao dia

Com alimentos
Os pacientes devem ser monitorados quanto a:
- Transaminases hepáticas e bilirrubina total pelo menos a cada quatro semanas após o início da terapia durante os primeiros 6 meses de tratamento e, posteriormente, conforme clinicamente indicado1*
- Contagem de leucócitos conforme clinicamente indicado e como parte do acompanhamento de rotina do paciente1†

Regime de tratamento em combinação com imunossupressores (RTX ou CYC/AZA)1
Referências e notas de rodapé
Notas de rodapé
*O tratamento deve ser reavaliado clinicamente e temporariamente interrompido se ALT ou AST for >3x LSN. O tratamento deve ser temporariamente suspenso se ALT ou AST for >5× LSN. Consulte a bula do produto para obter informações sobre a descontinuação permanente.1
†O tratamento deve ser temporariamente interrompido se o paciente desenvolver leucopenia (contagem de leucócitos <2×109/l), neutropenia (neutrófilos <1×109/l) ou linfopenia (linfócitos <0,2×109/l).1
Abreviações
VAA, vasculite associada ao ANCA; EA, evento adverso; ALT, alanina transaminase; ANCA, anticorpo anticitoplasma de neutrófilos; AST, aspartato transaminase; AZA, azatioprina; CYC, ciclofosfamida; CYP3A4; Citocromo P450 3A4; GC, glicocorticoide; GPA, granulomatose com poliangeíte; PAM, poliangeíte microscópica; RTX, rituximabe; EAG, evento adverso grave; EAET, evento adverso emergente do tratamento; LSN, limite superior normal; GBS,glóbulos brancos do sangue.
References
- TAVNEOS EU SmPC janeiro de 2025.
- Jayne D, et al. N Engl J Med 2021;384(7):599–609.
- European Medicines Agency (2021). An overview of Tavneos and why it is authorised in the EU. Available at: https://www.ema.europa.eu/en/documents/overview/tavneos-epar-medicine-overview_en.pdf. Data de acesso: janeiro de 2025.
- Jayne D, et al. J Am Soc Nephrol 2022:33.
▼ Este produto medicinal está sujeito a monitoramento adicional. Isso permitirá a rápida identificação de novas informações de segurança. Os profissionais de saúde são solicitados a relatar quaisquer suspeitas de reações adversas.
BR-AVA-2500003 | Data de preparação: julho de 2025
Mecanismo de ação
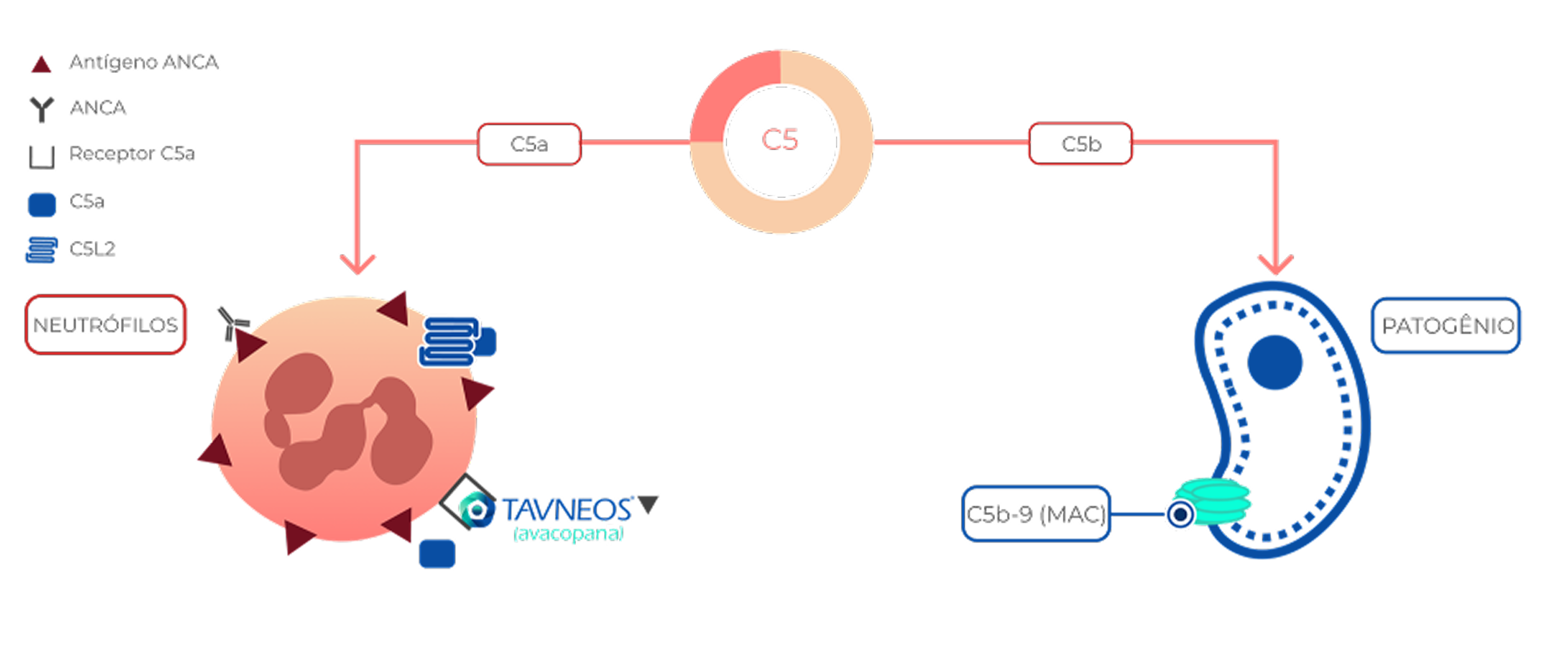
TERAPIA ALVO INOVADORA

TAVNEOS é a única terapia alvo para VAA (GPA/PAM) a abordar um importante fator chave dainflamação vascular na via alternativa do complemento2-4

A ativação da via alternativa do complemento desempenha um papel fundamental na VAA, e nenhuma terapia estabelecida aborda isso como um fator chave da inflamação vascular2,5-10
TRATAMENTO RECONHECIDO PELA EULAR 2022 E KDIGO 2024

Recomendações da EULAR para o manejo da vasculite associada ao ANCA: a atualização de 2022 reconheceu a capacidade do tratamento com TAVNEOS de melhorar o controle da doença, reduzindo a toxicidade de GC e melhorando a função renal11,12

Nível de evidência 1b da recomendação da Eular 2022:
TAVNEOS (avacopana) associado ao RTX ou CYC pode ser considerado para induzir a remissão na GPA ou PAM, como parte de uma estratégia para reduzir substancialmente a exposição aos GCs11
A diretriz de prática clínica da KDIGO 2024 para o manejo de vasculite associada ao ANCA reconhece a capacidade do TAVNEOS de controlar a doença, tendo o potencial de melhorar a função renal, reduzir a exposição ao GC e melhorar a qualidade de vida do paciente13

KDIGO 2024 PONTOS DE PRÁTICA 9.3.1.1 E 9.3.1.7:
TAVNEOS pode ser usado como uma alternativa aos GCs para indução da remissão em combinação com RTX ou CYC13*
Entenda mais sobre a patogênese da VAA e como o TAVNEOS funciona
Referências e notas de rodapé
Notas de rodapé
*Recomendação 9.3.1.1: Recomendamos que os GCs em combinação com RTX ou CYC sejam usados como tratamento inicial de VAA (1B). Ponto de prática 9.3.1.7: Avacopan pode ser usado como uma alternativa aos GCs. Pacientes com maior risco de toxicidade por GC provavelmente serão mais beneficiados com o uso da avacopana. Os pacientes com TFG baixa podem se beneficiar com uma maior recuperação da TFG.13
Abreviações
VAA, vasculite associada ao ANCA; ANCA, anticorpo anticitoplasma de neutrófilos; C5a, componente 5a do sistema complemento; C5b, componente 5b do sistema complemento; C5L2, C5a semelhante ao receptor 2; CYC, ciclofosfamida; EULAR, Aliança Europeia de Associações de Reumatologia; GC, glicocorticoide; TFG, taxa de filtração glomerular; GPA, granulomatose com poliangeíte; KDIGO, Kidney Disease: Improving Global Outcomes; MAC, complexo de ataque à membrana; MOA, mecanismo de ação; PAM, poliangeíte microscópica; RTX, rituximabe.
Referências
- TAVNEOS EU SmPC janeiro de 2025.
- Bekker P, et al. PLoS ONE 2016;11(10):e0164646.
- Moiseev S, et al. Clin Exp Immunol 2020;202(3):394–402.
- European Medicine Agency (2021). First-in-class medicine recommended for treatment of rare blood vessel inflammation. Available at: https://www.ema.europa.eu/en/news/first-class-medicine-recommended-treatment-rare-blood-vessel-inflammation. Data de acesso: janeiro de 2025.
- Hutton HL, et al. Semin Nephrol 2017;37(5):418–35.
- Jennette JC, Nachman PH. Clin J Am Soc Nephrol 2017;12(10):1680–91.
- Al-Hussain T, et al. Adv Anat Pathol 2017;24(4):226–34.
- Lamprecht P, et al. EMJ Rheumatol 2021;8(1):36–42.
- Liberman AC, et al. Front Endocrinol (Lausanne) 2018;9:235.
- Nozaki Y. Front Immunol 2021;12:631055.
- Hellmich B, et al. Ann Rheum Dis 2023;0:1–18.
- Jayne D, et al. N Eng J Med 2021;384(7):599–609.
- Kidney Disease: Improving Global Outcomes (KDIGO) ANCA Vasculitis Work Group. Kidney Int 2024;105(3S):S71–116.
▼ This medicinal product is subject to additional monitoring. This will allow quick identification of new safety information. Healthcare professionals are asked to report any suspected adverse reactions.
BR-AVA-2500003 | Data de preparação: julho de 2025
Recursos
Referências e notas de rodapé
Abreviações
VAA, vasculite associada ao ANCA; ANCA, anticorpo anticitoplasma de neutrófilos; GPA, granulomatose com poliangeíte; MOA, mecanismo de ação; PAM, poliangeíte microscópica
References
- TAVNEOS EU SmPC janeiro de 2025.
▼ Este produto medicinal está sujeito a monitoramento adicional. Isso permitirá a rápida identificação de novas informações de segurança. Os profissionais de saúde são solicitados a relatar quaisquer suspeitas de reações adversas.
BR-AVA-2500003 | Data de preparação: julho de 2025
Relatorio de evento adverso. Para sanar dúvidas sobre produtos e reportar algum relato de reações adversas/farmacovigilância, envie um e-mail para sac@blanver.com.br ou contate o 0800 892 2166. A equipe está à disposição para sanar dúvidas e prestar o atendimento necessário.
Outras dúvidas, envie um e-mail para info.br@viforpharma.com.